Vuoi ricevere i nostri aggiornamenti?
Mdr, la sorveglianza post commercializzazione del fabbricante: gli adempimenti

Nell’articolo della settimana scorsa abbiamo analizzato i principi cardine della sorveglianza post-commercializzazione. Di seguito vediamo gli specifici adempimenti collegati a tali attività.
Sorveglianza post commercializzazione
Come già accennato rientrano nella nozione di sorveglianza post commercializzazione (indicata spesso con la sigla Pms – Post marketing surveillance) “tutte le attività svolte da fabbricanti in collaborazione con altri operatori economici volte a istituire e tenere aggiornata una procedura sistematica per raccogliere e analizzare in modo proattivo l’esperienza acquisita sui dispositivi che immettono sul mercato, che mettono a disposizione sul mercato o che mettono in servizio, al fine di identificare eventuali necessità di procedere immediatamente a eventuali azioni correttive o preventive” (art. 2 lett. 60 Mdr).
Tenuto conto che tale sorveglianza deve essere “sistematica” e che l’importante obiettivo è quello di “attuare e monitorare eventuali azioni preventive e correttive” (art. 83), il legislatore comunitario ha previsto come obbligatori alcuni adempimenti specifici.
Gli obblighi
In particolare l’obbligo di istituire un piano di sorveglianza post commercializzazione (art. 84) – (cosiddetto Pmsp)
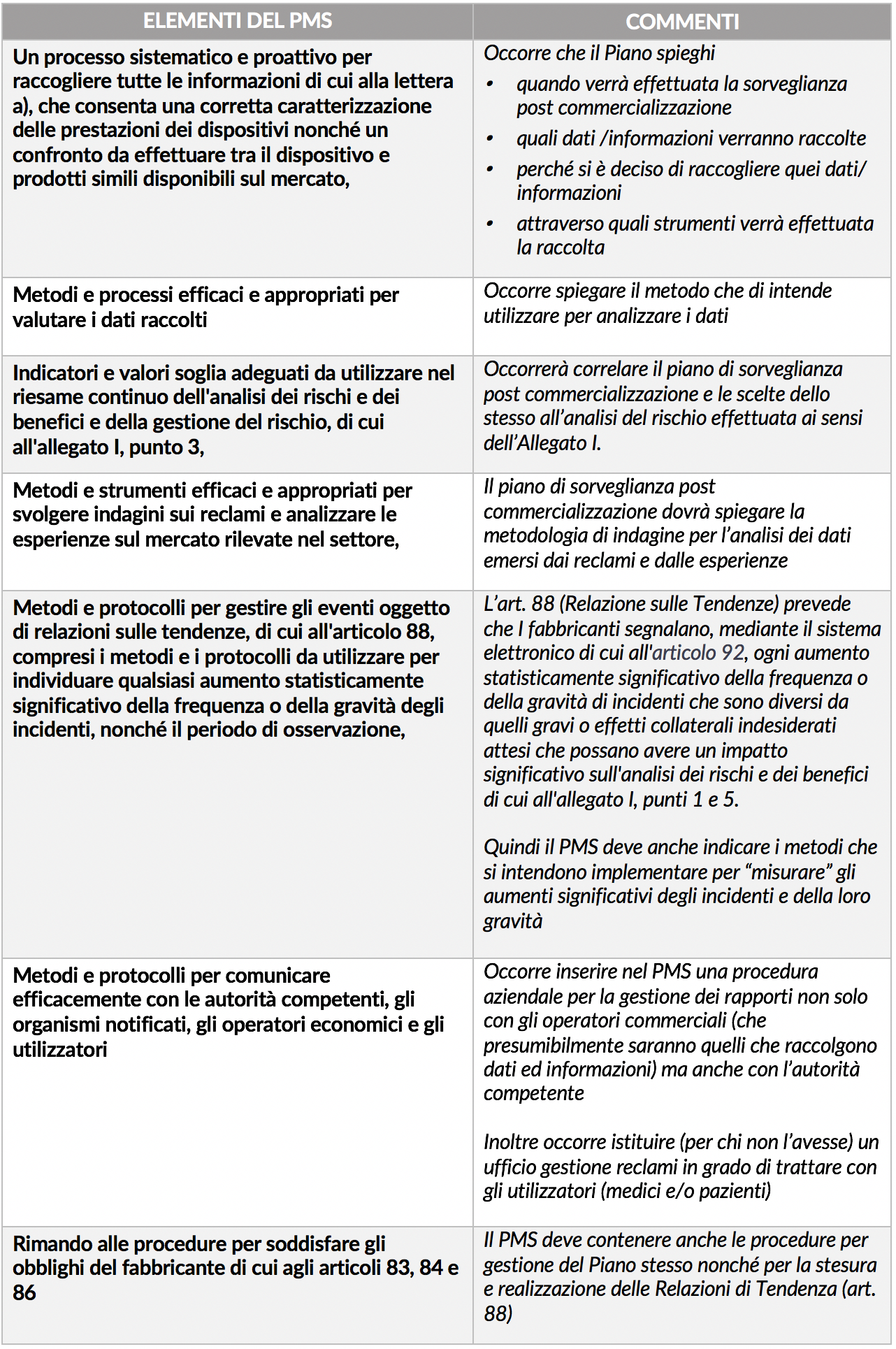
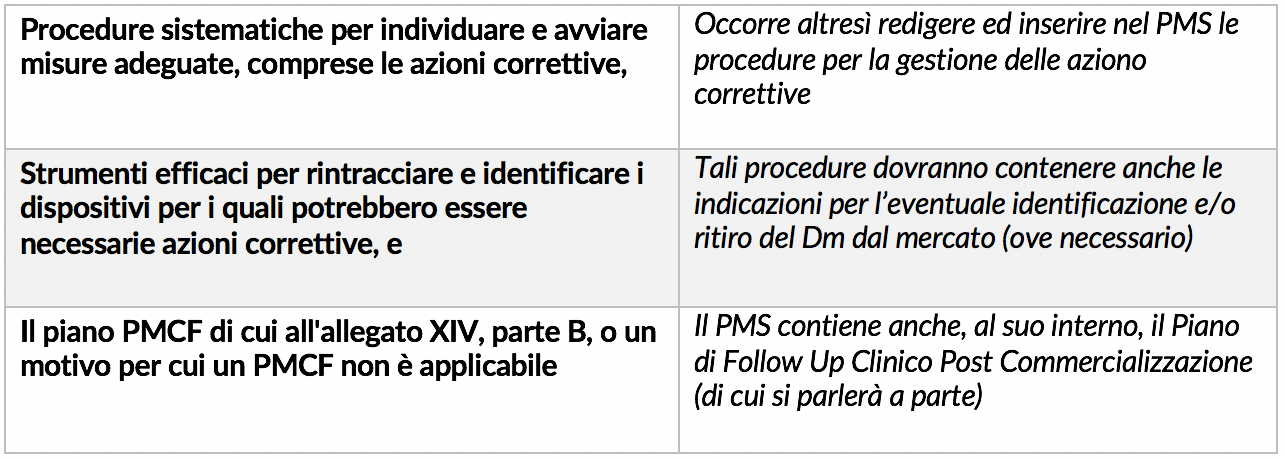
Tale documento – che fa parte dei documenti che obbligatoriamente il fabbricante deve avere ai sensi dell’allegato II – è senza dubbio piuttosto complesso ed articolato. Lo stesso art. 84 stabilisce infatti che tale Piano deve rispettare le indicazioni di cui all’allegato III punto 1.1.
L’allegato, oltre a definire la tipologia di informazioni che devono essere raccolte (già riportate nello schema della scorsa settimana) tale Allegato stabilisce elementi e metodi che devono essere inseriti nel Piano. Di seguito in dettaglio tali elementi con un breve commenti a fianco.