Vuoi ricevere i nostri aggiornamenti?
La sorveglianza post commercializzazione del fabbricante di dispositivi medici: i principi cardine

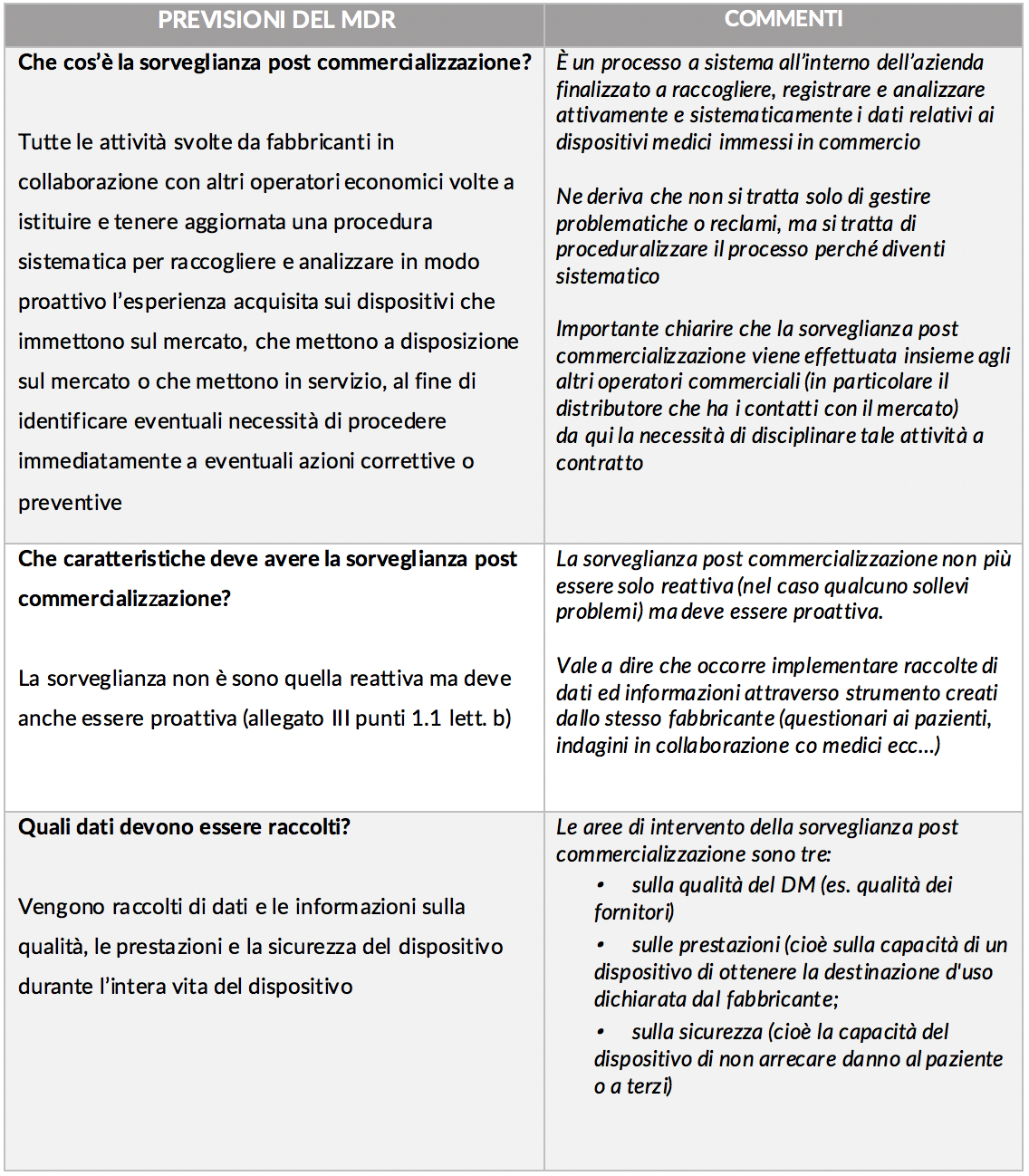
Non vi è dubbio che la nuova disciplina contenuta nell’Mdr (regolamento per i dispositivi medici) relativamente al sistema di sorveglianza post commercializzazione renda tale istituto uno degli snodi fondamentali dell’intero sistema.
Dispositivi medici, l’importanza della sorveglianza post-commercializzazione
Attraverso la sorveglianza post-commercializzazione infatti il fabbricante raccoglie – in maniera puntuale e sistematica – una serie di dati ed informazioni che gli consentono di verificare il rispetto dei requisiti essenziali di sicurezza nonché apportare tutti i miglioramenti necessari.
È quindi lo strumento che consente di creare quella “circolarità” del sistema che caratterizza il nuovo Mdr. Il tema merita dunque di essere approfondito in tutti i suoi aspetti.
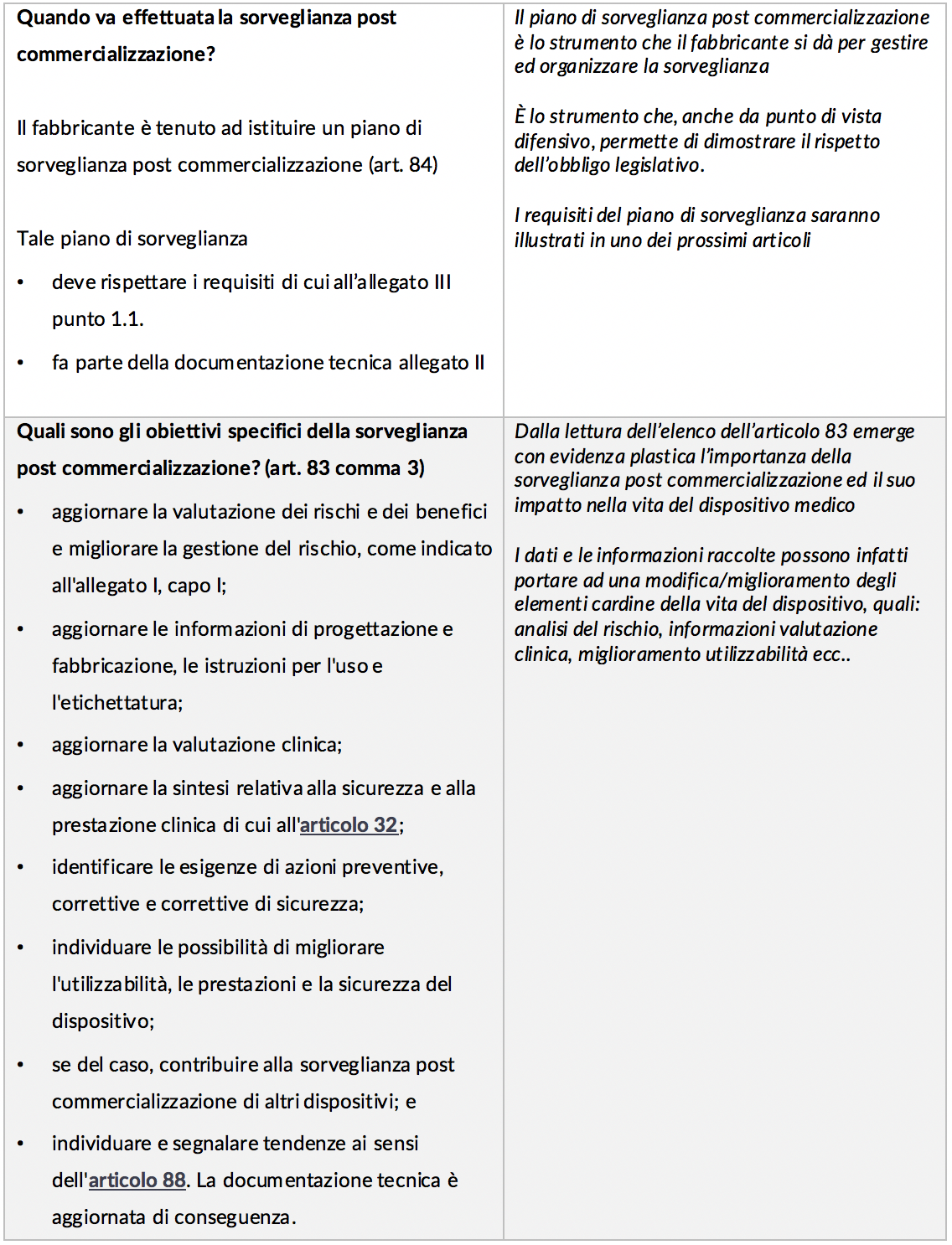
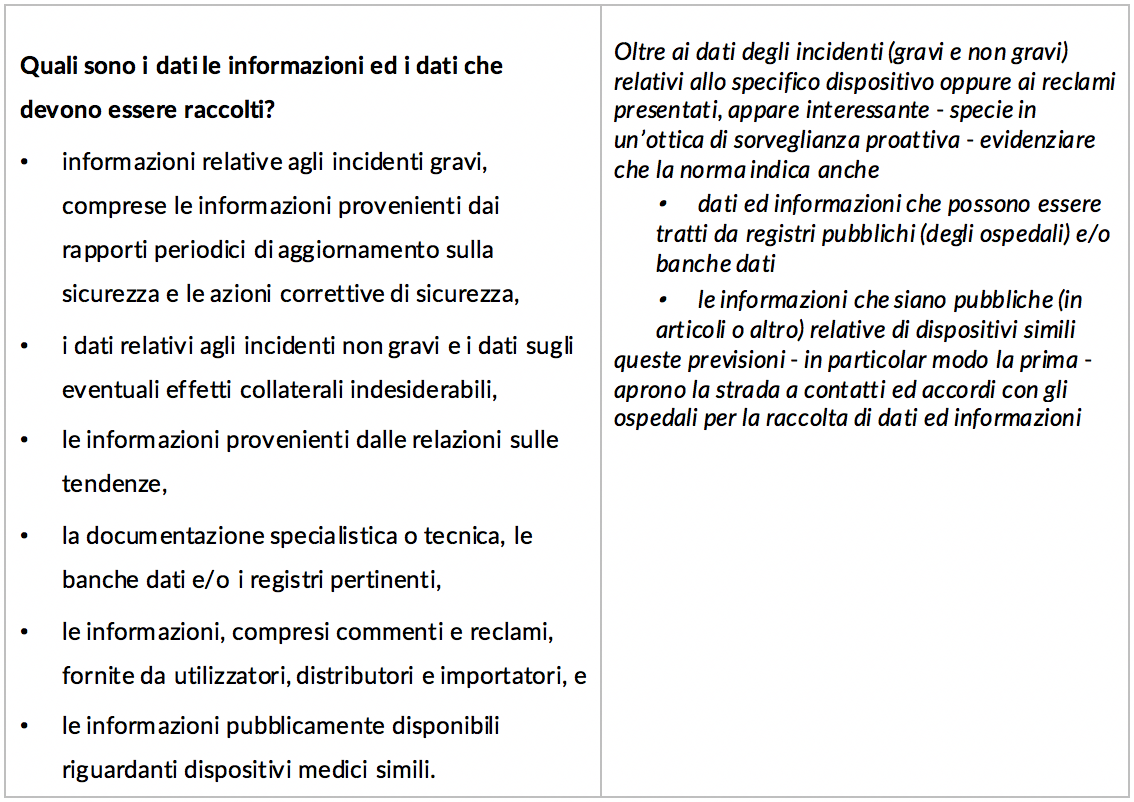
Pertanto in questo primo articolo analizzeremo, partendo dal dettato legislativo, i punti cardine della nuova disciplina per poi approfondire, in articoli successivi che verranno, alcuni profili di particolare interesse. Per facilità di lettura abbiamo creato uno schema dei principali profili con un breve commento nella colonna di destra.