Vuoi ricevere i nostri aggiornamenti?
Per il periodo transitorio del Mdr l’articolo 120 detta legge. Gli elementi base da tenere a mente

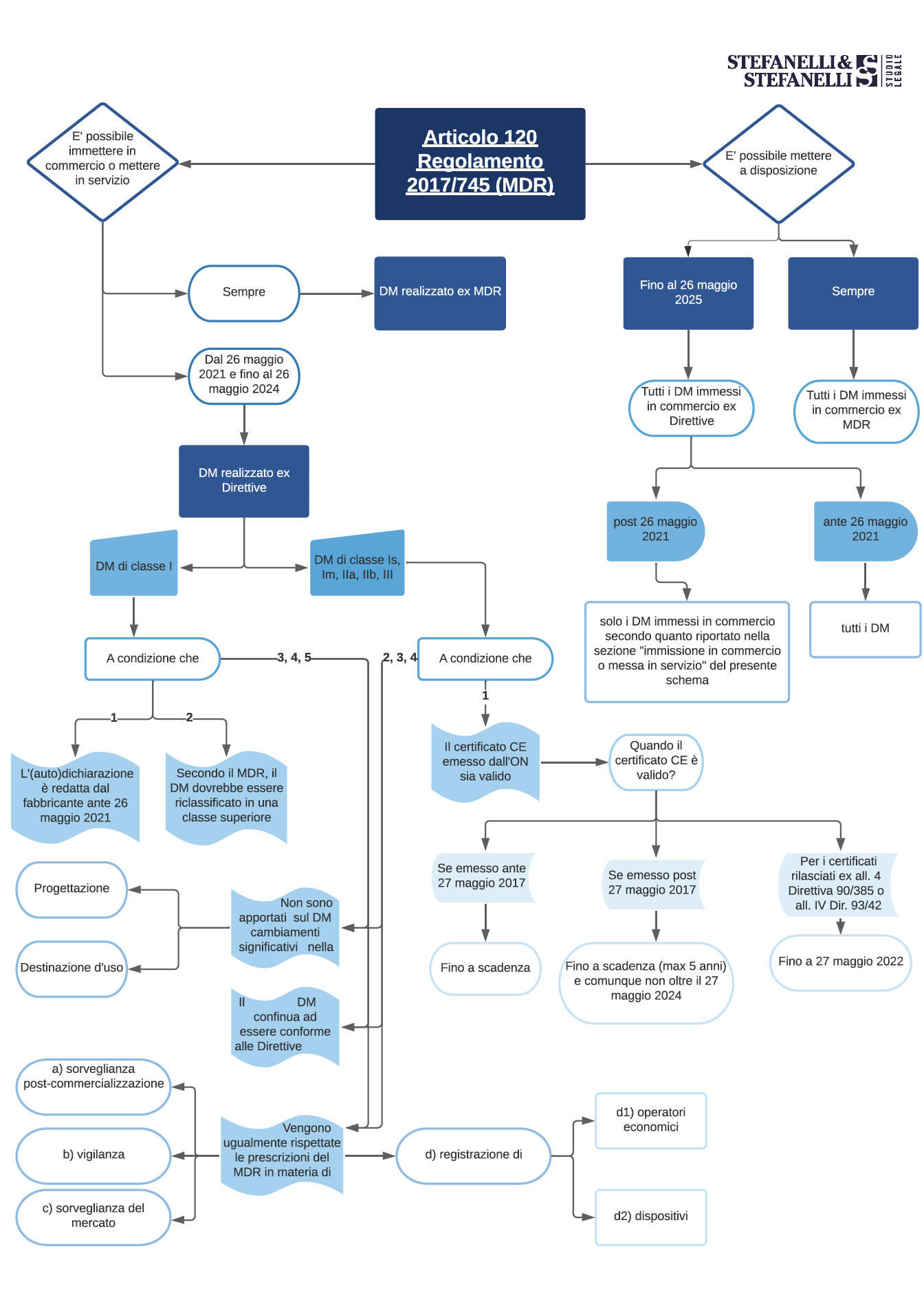
Con l’avvicinarsi del 26 maggio 2021, acquista sempre più importanza capire bene i contenuti dell’articolo 120 del Mdr (modificato dapprima con la rettifica del 27 dicembre 2019 e poi con il Reg. Ue 2020/561): la norma infatti detta le regole per il periodo transitorio. Capirne il funzionamento, dunque, diventa imprescindibile per una corretta immissione in commercio e messa in servizio dei Dm. Abbiamo allora creato uno schema che si propone di esemplificare il contenuto e le disposizioni dell’articolo 120 Mdr.
Per poter comprendere l’applicazione della norma vanno chiarite le definizioni giuridiche di:
- immissione in commercio e messa a disposizione;
- messa in servizio
Immissione in commercio
Il Mdr definisce l’”immissione in commercio” all’articolo 2, punto 28, come “la prima messa a disposizione di un dispositivo, diverso da un dispositivo oggetto di indagine, sul mercato dell’Unione”. A sua volta, viene definita “messa a disposizione” (art. 2, punto 27) “la fornitura di un dispositivo, diverso da un dispositivo oggetto di indagine, per la distribuzione, il consumo o l’uso sul mercato dell’Unione nel corso di un’attività commerciale, a titolo oneroso o gratuito”.
Come poi ulteriormente specificato dalla “Guida blu all’attuazione della normativa Ue sui prodotti 2016”, uno dei principali documenti di riferimento sulle modalità di attuazione della legislazione sui prodotti in ambito europeo, i concetti di immissione in commercio e messa a disposizione si riferiscono ad ogni singolo prodotto e non al tipo di prodotto. Di conseguenza, anche nell’ambito di una produzione in serie, dovrà ugualmente farsi riferimento al singolo dispositivo medico per verificare quando lo stesso possa dirsi immesso in commercio e/o messo a disposizione. Infine, si ha immissione in commercio con la semplice offerta o un accordo (scritto o verbale) per il trasferimento della proprietà, del possesso o di qualsivoglia altro diritto di proprietà sul prodotto. Inoltre:
- deve essere stata completata la fase di fabbricazione;
- non è necessaria la consegna materiale del Dm.
Messa in servizio
Viene poi definita “messa in servizio” (art. 2, punto 29) “la fase in cui un dispositivo, diverso da un dispositivo oggetto di indagine, è stato reso disponibile all’utilizzatore finale in quanto pronto per il primo utilizzo sul mercato dell’Unione secondo la sua destinazione d’uso”. Occorrerà dunque fare riferimento al momento del primo utilizzo di un Dm all’interno dell’Ue da parte dell’utilizzatore finale, per il fine a cui il prodotto è stato destinato dal fabbricante nell’etichettatura e/o nella documentazione tecnica.
(clicca per ingrandire)