Vuoi ricevere i nostri aggiornamenti?
Mascherine come Dpi e Dm, la normativa non è sempre chiara

Chiusa la Fase 1, l’Italia si avvia a convivere con il virus. Con (qualche) spostamento consentito, ammesso che si indossino sistemi di protezione individuale: cioè le mascherine (art. 1 del nuovo Dpcm 26 aprile 2020). E proprio sul tema delle mascherine, negli ultimi 10 gg è successo di tutto. In primo luogo si è preso atto che sul mercato circolano moltissime mascherine prive dei corretti certificati e infatti Accredia sul suo sito ha pubblicato sei esempi di certificati falsi relativi alle mascherine, mentre a livello europeo l’European safety federation ha pubblicato una intera pagina nella quale si illustrano i principali casi di certificati falsi nell’ambito dei prodotti che girano oggi sul mercato (tale pagina analizza anche certificati di prodotti ulteriori rispetto alle mascherine).
La normativa in Italia
Contemporaneamente il legislatore italiano ha convertito in legge il cosiddetto decreto Cura Italia (legge 24 aprile 2020 n. 27, qui il testo coordinato) con il quale si rinnova il regime in deroga (articoli 15 e 16) che consente la commercializzazione mascherine prive di marcatura CE previa valutazione in capo all’Inail (se sono Dpi) o all’Iss (se sono Dm).
Nella stessa settimana poi il ministero della Salute con Ordinanza 26 aprile 2020 ha consentito l’importazione di mascherine anche in assenza di iscrizione nella Banca dati dispositivi medici del ministero della Salute e prive dell’etichettatura in italiano, mentre il Commissario Arcuri nella stessa data ha emanato l’Ordinanza 11/2020 con la quale è stato stabilito che il prezzo al pubblico delle sole mascherine Dm non può essere superiore a 0,50 euro. A seguito delle lamentele di farmacisti (che avevano già acquistato ad un importo più alto) sabato notte è stato siglato un protocollo d’intesa con le associazioni di settore per il rimborso da parte dello Stato della differenza pagata in più rispetto al prezzo fisso di vendita. Nel corso della settimana successiva si ha poi avuto notizia anche di numerosi controlli della Guardia di Finanza.
Una normativa non chiara
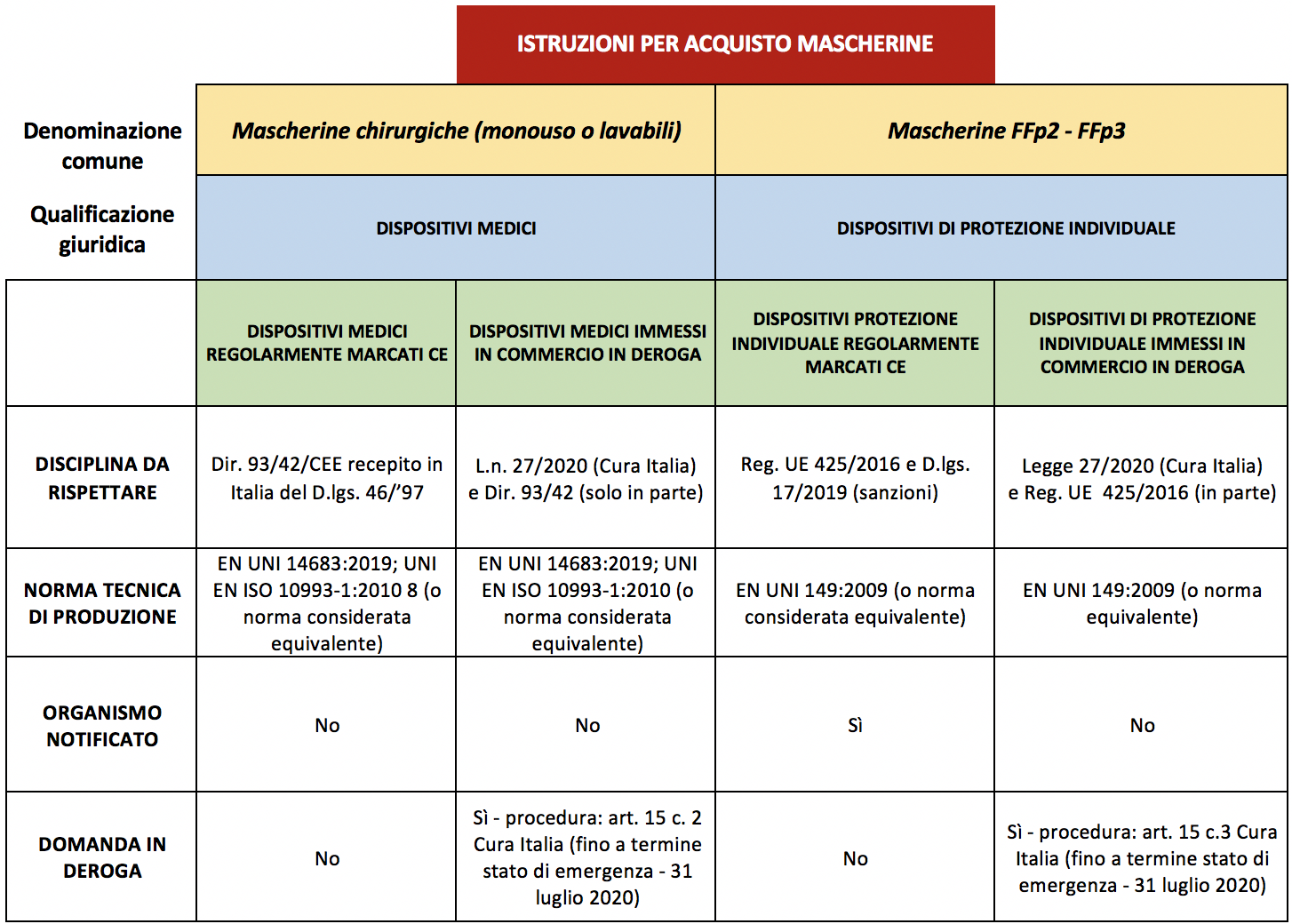
Alla situazione di cui sopra, fa sponda sul mercato, una situazione a dir poco caotica. La maggior parte degli importatori, grossisti, distributori e, da ultimo, farmacisti non hanno assolutamente chiari i profili legislativi di tale tipologia di prodotti che stanno acquistando né, quindi, di cosa chiedere in sede di acquisto. Vediamo di riepilogare brevemente. Le mascherine possono avere diverse qualificazioni giuridiche a seconda della loro funzione. Più esattamente possono essere:
- Dispositivi medici (“Dm”)
- Dispositivi di protezione individuale (“Dpi”)
- Prodotti generici
Mascherina come dispositivo medico (mascherine chirurgiche)
Disciplina ordinaria
La disciplina di riferimento è la Dir 93/42/CEE recepita in Italia dal D.Lgs 46/’92. In applicazione di tale disciplina i dispositivi medici possono essere immessi in commercio se rispettano i Requisiti essenziali di sicurezza – cosiddetti Res (allegato I).
I dispositivi, poi, si dividono in 4 classi di rischio (Allegato IX) : Classe I, Classe IIa, Classe IIB, Classe III e le procedure per dimostrare il rispetto dei Res sono diverse a seconda della Classe di rischio (art. 11). Le maschere facciali ad uso medico sono dispositivi medici non invasivi di Classe I. Vengono solitamente prodotte in base alla EN UNI 14683 punto 4 (norma tecnica di produzione delle mascherine facciali) all’interno della quale le mascherine sono suddivise in tre tipi:
- Tipo I – con una minore efficienza di filtrazione
- Tipo II – con una maggiore efficienza di filtrazione, ma non resistente agli spruzzi;
- Tipo IIR – quando presentano resistenza agli spruzzi
Essendo un dispositivo di Classe I non sarà necessario l’intervento dell’Organismo notificato (art. 11 comma 5), ma il fabbricante potrà realizzare in autonomia il suo fascicolo tecnico emettendo al termine la dichiarazione di conformità alla Direttiva (Allegato VII).
Se il fabbricante è extraeuropeo dovrà poi nominare un mandatario sul territorio comunitario.
Inoltre il fabbricante dovrà:
- imballare il dispositivo medico in modo tale che le sue caratteristiche e prestazioni non vengano alterate durante la conservazione e il trasporto, tenendo anche in considerazione della specifica destinazione d’uso prevista
- corredare il dispositivo medico di adeguata etichetta, conformemente all’Allegato I, capo III, punto 13, includendo le informazioni di cui al punto 13.3
- redigere le istruzioni d’uso conformemente all’Allegato I, capo III, punto 13, inserendo in particolare tutte le informazioni di cui al punto 13.6
Disciplina in deroga
Per fronteggiare la grave situazione di emergenza sanitaria attualmente in atto e per far fronte alla crescente domanda di mascherine da parte dei professionisti sanitari e della popolazione in generale, il legislatore ha introdotto una serie di importanti deroghe al procedimento sopra illustrate contenute all’art 15 del c.d. Cura Italia (Decreto-Legge 18/2020 convertito con la legge n. 27/2020 pubblicata in GU il 29 aprile 2020 n. 110)
Questo gli step dell’iter di deroga
- Rispettare le norme di produzione che garantiscano i requisiti di sicurezza
Le norne tecniche di produzione indicate sul sito dell’Iss (sono nello specifico sito la UNI EN 14683:2019 “Mascherine facciali ad uso medico – requisiti e metodi di prova” e la UNI EN ISO 10993-1:2010 “Valutazione biologica dei dispositivi medici – Parte 1: Valutazione e prove all’interno di un processo di gestione del rischio”. Si precisa in ogni caso che è obbligatorio il rispetto dei Res, mentre le norme tecniche rappresentano solo lo stato dell’arte.
- Redigere la domanda di valutazione in deroga – secondo il modello scaricabile sul sito dell’Iss
- Redigere un’autocertificazione in deroga – in cui si afferma sotto la propria responsabilità di aver rispettato tutti i requisiti essenziali previsti per la realizzazione del DM. Il relativo modello è scaricabile dalla pagina dell’ISS;
- Inviare l’autodichiarazione e la domanda di valutazione all’Iss
- Inviare entro i successivi 3 giorni ogni altra documentazione utile – la documentazione da inoltrare dovrà essere quella idonea a dimostrare il rispetto dei requisiti essenziali, per come dichiarato nell’autocertificazione e nella domanda. A tal fine, l’ISS ha predisposto il documento “Documentazione tecnica: specifiche” per aiutare nella scelta della corretta documentazione da inoltrare per l’accettazione della propria domanda.
- Attendere la pronuncia dell’Iss nei 3 giorni successivi (che di solito sono più di 3): se il parere è positivo si può commercializzare, se il parere è negativo non si può commercializzare.
Tale procedimento in deroga potrà essere seguiti esclusivamente durante il periodo di emergenza, che (allo stato) terminerà il 31 luglio 2020 (Delibera consiglio di Ministeri 31 gennaio 2020). Al termine, infatti, i fabbricanti di Dpi e Dm dovranno ricominciare ad utilizzare i procedimenti ordinari previsti dalla rispettiva normativa.
Mascherina qualificata come dispositivo di protezione individuale
Regime ordinario
I dispositivi di protezione individuale sono invece regolati dal Regolamento Ue 425/2016 (e dal Decreto Legislativo 17/2019 solo per le sanzioni). Anche in questo caso quindi il fabbricante di un prodotto dovrà rispettare i requisiti essenziali di salute e sicurezza di cui all’Allegato II.
I Dpi sono poi divisi in Categorie di rischio (Allegato I)
- i Dpi di Cat. I che potranno essere messi in commercio previa Dichiarazione di Conformità, mentre
- i Dpi di Cat. II e Cat. III che dovranno passare il vaglio di un Organismo notificato che emetterà il Certificato CE a seguito del quale il fabbricante potrà emettere la Dichiarazione di conformità.
Le mascherine qualificate come DPI appartengono alla Classe III.
Vengono solitamente realizzare seguendo la norma tecnica EN 149:2001 che le suddivide in base alla loro efficaciafiltrante l’interno in tre livelli: FFP1, FFP2 ed FFP3.
Il fabbricante della mascherina Dpi dovrà quindi
- redigere la documentazione tecnica relativa al DPI di cui all’Allegato III
- coinvolgere un Organismo notificato che emani un certificato CE (l’elenco degli organismi accreditati al rilascio dei Certificati CE per il Reg Ue 2026/425 può essere verificato su sul sito web NANDO).
- redigere la Dichiarazione di Conformità utilizzando la struttura tipo contenuta nell’Allegato IX, al fine di dimostrare il rispetto dei requisiti essenziali di salute e sicurezza applicabili nella fabbricazione del Dpi
- apporre la marcatura CE conformemente all’articolo 16
- corredare il Dpi delle istruzioni e informazioni di cui all’Allegato II, capo I, punto 1.4
Regime in deroga
Analogamente a quanto previsto per le maschere chirurgiche, anche per i Dpi è previsto un regime in deroga in base al quale un soggetto che intende produrre o un importatore deve presentare domanda di valutazione in deroga più autocertificazione.
Le differenze rispetto all’iter precedente sono le seguenti:
- L’organo preposto alla valutazione delle domande e delle autocertificazioni nel caso del Dpi è l’Inail
- I requisiti che dovranno rispettarsi nel caso delle maschere Dpi saranno quelli di cui all’Allegato II del Regolamento 425/2016.
Le “Istruzioni operative del 19 maggio 2020” pubblicate dall’Inail contengono il modello di autocertificazione del rispetto dei requisiti essenziali da inviare all’ente. In tale documento si richiede inoltre che alla menzionata autocertificazione siano allegati i documenti che consentono la valutazione del Dpi, incluse:
- una relazione tecnica descrittiva completa del Dpi e dell’uso a cui è destinato
- relazioni e relativi rapporti di prova sui test effettuati per verificare la conformità del DPI ai requisiti essenziali di salute e sicurezza (EN 149:2001 o norme equivalenti)
- una copia delle istruzioni per il datore di lavoro
Anche in questo caso, qualora la valutazione dell’Inail sia positiva, la commercializzazione di tali DPI sarà legittima nel perdurare dello stato di emergenza e avverrà senza apposizione della marcatura CE.
Qualora invece sia negativa, “il produttore ne cessa immediatamente la produzione e all’importatore è fatto divieto di immissione in commercio” (art. 15 c.4 Cura Italia).
Mascherine che non sono né Dpi né Dm
Infine, l’art. 16 c.2 fornisce ulteriori misure di protezione a favore dei lavoratori e della collettività della attuale versione del Cura Italia e stabilisce che:
- Ai fini del comma 1, fino al termine dello stato di emergenza di cui alla delibera del Consiglio dei ministri in data 31 gennaio 2020, gli individui presenti sull’intero territorio nazionale sono autorizzati all’utilizzo di mascherine filtranti prive del marchio CE e prodotte in deroga alle vigenti norme sull’immissione in commercio.
Pur nella scarsa chiarezza della formulazione della norma si reputa infatti si tratti di mascherine che non essendo né Dm né Dpi dovranno farsi rientrare sotto la disciplina generale del Codice del consumo. È assolutamente necessario in questo caso indicare con chiarezza nell’etichetta sul confezionamento che non si tratta né di un Dm né di un Dpi.
Sotto uno schema riepilogativo delle diverse fattispecie con l’indicazione di cosa chiedere al momento dell’acquisto.