Vuoi ricevere i nostri aggiornamenti?
App e telemedicina, i profili giuridici con il nuovo regolamento MDR

Sull’articolo della settimana scorsa pubblicato a firma di Sergio Pillon (coordinatore della Commissione tecnica paritetica del ministero della Salute per lo sviluppo della telemedicina nazionale) relativo allo sviluppo della sanità digitale in Italia, si porta ed esempio l’organizzazione israeliana del servizio sanitario affermando che “la sanità digitale è l’elemento portante del sistema, centrata, dal punto di vista del paziente, su servizi offerti attraverso app e sostenuti dai Big data e dalla rete”. Chi scrive è della stessa opinione. L’utilizzo di software e app in area sanitaria e le potenzialità legate al trattamento dei dati raccolti attraverso i software possono portare a un rilevante cambiamento dell’organizzazione del nostro servizio sanitario, pubblico e privato. Occorre allora aver ben chiari quali cambiamenti giuridici comporta il nuovo MDR nel settore software e app medicali.
I punti cardine da analizzare
Innanzi tutto bisogna stabilire quando un software/app diventa dispositivo medico o accessorio, rientrando quindi nella disciplina di cui al Mdr. E in seguito stabilire quale classe di rischio si debba applicare alla luce della nuova disciplina.
La qualificazione giuridica del software
I nuovi orizzonti che si aprono in materia di software con il nuovo Mdr sono già stati anticipati dalla sentenza della Corte di Giustizia comunità europee del 7 dicembre 2017 – C 329/16, che merita un breve commento. La sentenza scaturisce da una controversia promossa dalla associazione francese Sniterm (impresa tecnologia medicale) nel corso della quale si chiedeva alla Corte di Giustizia di valutare se il software che presenti “una funzionalità che consenta l’utilizzo dei dati personali di un paziente al fine di aiutare il suo medico nella predisposizione della sua prescrizione, in particolare rilevando le controindicazioni, le interazioni con altri medicinali e le posologie eccessive” debba o meno essere considerato dispositivo medico, tenuto conto in particolare che lo stesso non risulta impiegato 'nel' o 'sul' corpo umano.
La Corte – dopo aver richiamato la precedente CGCE 22 novembre 2012 C-219/11 (cosiddetto caso Brain product) nella quale la Corte ha dichiarato che un software costituisce un dispositivo medico, unicamente quando è destinato ad uno scopo medico e non quando ha uno scopo di ricerca – pur dando atto che l’articolo 1 lett. a) della Dir 93/42/Cee (applicabile all’epoca) fa riferimento a un 'impiego sull’uomo', hanno richiamato il Considerando 6 della dir 2007/47 ove si afferma in maniera ampia che “un software è di per sé un dispositivo medico quando è specificamente destinato dal fabbricante ad essere impiegato per una o più delle finalità mediche stabilite nella definizione di dispositivo medico” e partendo da tale assunto hanno dichiarato che il software può essere dispositivo medico anche senza impiego 'sull’uomo'.
Secondo i giudici della Corte quindi “il legislatore dell’Unione ha inteso concentrarsi, per qualificare un software come dispositivo medico, sullo scopo del suo utilizzo e non sul modo in cui può concretizzarsi l’effetto che è in grado di produrre sul o nel corpo umano”. Di conseguenza “ai fini della qualificazione di dispositivo medico, il fatto che un software agisca direttamente o non agisca direttamente sul corpo umano, non è rilevante, essendo invece fondamentale che la finalità indicata dal fabbricante sia una di quelle previste per la definizione stessa di dispositivo”.
Il rafforzamento del nuovo Mdr
Tale ampliamento giurisprudenziale della nozione, è poi oggi rinforzata nel nuovo Mdr. In primo luogo infatti il Considerando 19 stabilisce che “è necessario precisare che il software destinato dal fabbricante a essere impiegato per una o più delle destinazioni d’uso mediche indicate nella definizione di dispositivo medico si considera un dispositivo medico, mentre il software destinato a finalità generali, anche se utilizzato in un contesto sanitario, o il software per fini associati allo stile di vita e al benessere non è un dispositivo medico. La qualifica di software, sia come dispositivo sia come accessorio, è indipendente dall’ubicazione del software o dal tipo di interconnessione tra il software e un dispositivo”.
La nozione di “accessorio”
Inoltre la nozione di “accessorio” nella Mdr è più ampia rispetto alla precedente nozioni di cui alla Dir 93/42/Cee. L’articolo 2 lett. 2 stabilisce infatti che si qualifica come accessorio di un dispositivo medico “un prodotto che, pur non essendo esso stesso un dispositivo medico, è destinato dal fabbricante a essere utilizzato con uno o più dispositivi medici specifici, per permettere in particolare che questi ultimi siano impiegati conformemente alla loro destinazione d’uso, oppure per assistere specificamente e direttamente la funzionalità sul piano medico del dispositivo o dei dispositivi medici in relazione alla loro destinazione d’uso”. Se infatti la prima parte dell’articolo ricalca la precedente nozione di accessorio (articolo 1 lett. b), la seconda parte delle norma allarga la nozione di accessorio anche a tutti i prodotti che “assistono la funzionalità sul piano medico di un dispositivo medico” portando quindi ad un aumento dei prodotti – specie di area software – che dovranno essere qualificati come accessori di dispositivi medici, con conseguente applicazione agli stessi dell’intero Mdr.
Classe di rischio
All’aumento del numero di software/app che dovranno farsi rientrare nella nozione giuridica di dispositivo medici/accessorio, si aggiungerà anche una possibile “crescita” della classe di rischio del software. Mentre infatti, oggi, buona parte dei software (e la maggior parte delle app) rientrano nella classe di rischio I (quindi con apposizione della marcatura Ce senza l’intervento dell’organismo notificato) la nuova regola 11 dell’Mdr stabilisce regole ben diverse, riepilogate nelle schema che segue.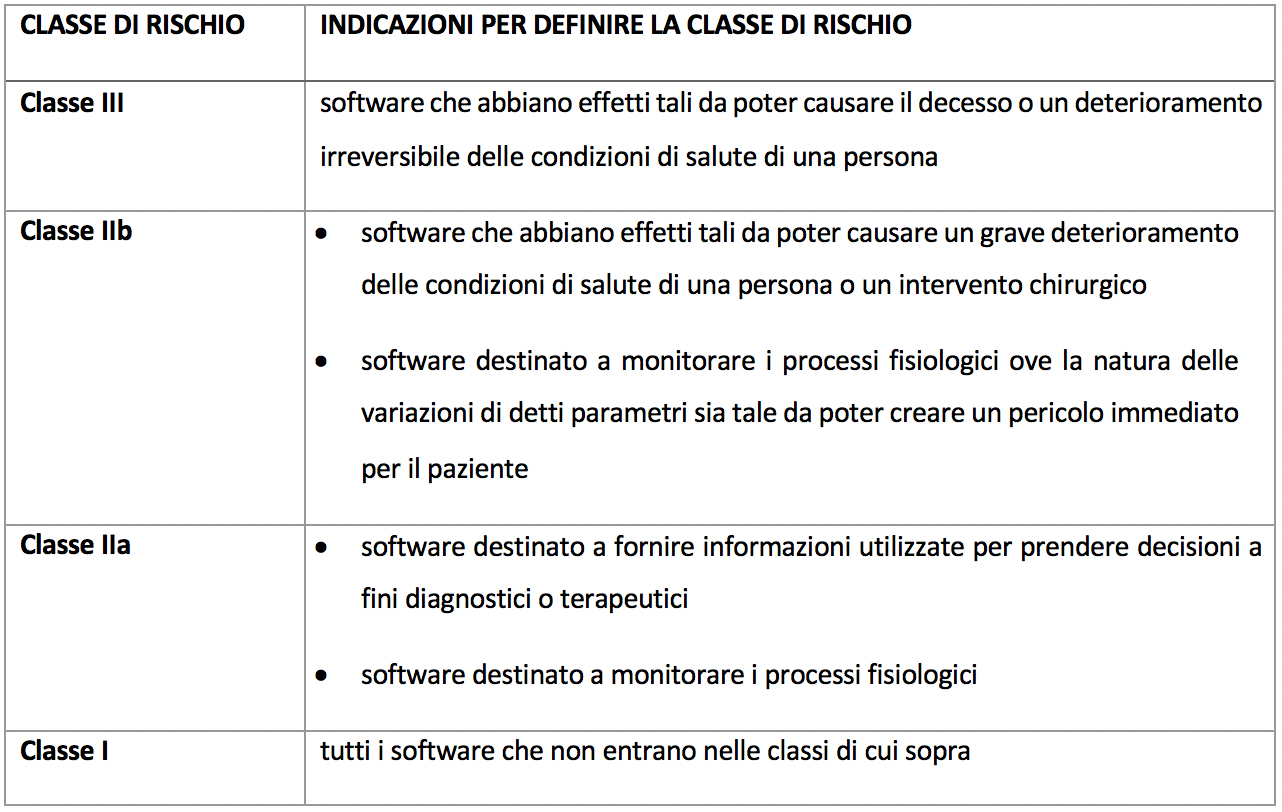
Dallo schema sopra, appare chiaro come tutti i software che vanno a monitorare processi fisiologici o che comunque forniscono al medico informazioni utilizzate per prendere decisioni diagnostiche o terapeutiche (previsione veramente ampia) rientreranno nella classe IIA o IIB, con conseguente coinvolgimento dell’organismo notificato. Inoltre quando secondo la regola 3.3 “il software destinato a far funzionare un dispositivo o a influenzarne l’uso rientra nella stessa classe del dispositivo”. Pacifico quindi che il quadro giuridico è fortemente cambiato, con un importante impatto, anche economico, sul mercato.