Vuoi ricevere i nostri aggiornamenti?
Come stabilire se un software è un dispositivo medico: un aiuto dalla Commissione Europea
La crescita esponenziale dell’utilizzo delle tecnologie in sanità è ormai un dato noto.
È altrettanto evidente che molte di queste tecnologie sono (o dovranno essere qualificate) come dispositivi medici ai sensi del nuovo MDR, che ha ridisegnato (allargandola) la nozione di “accessorio” di dispositivo medico, facendo rientrare sotto il cappello legislativo del Regolamento anche molti dei software che fino ad ora non erano considerati.
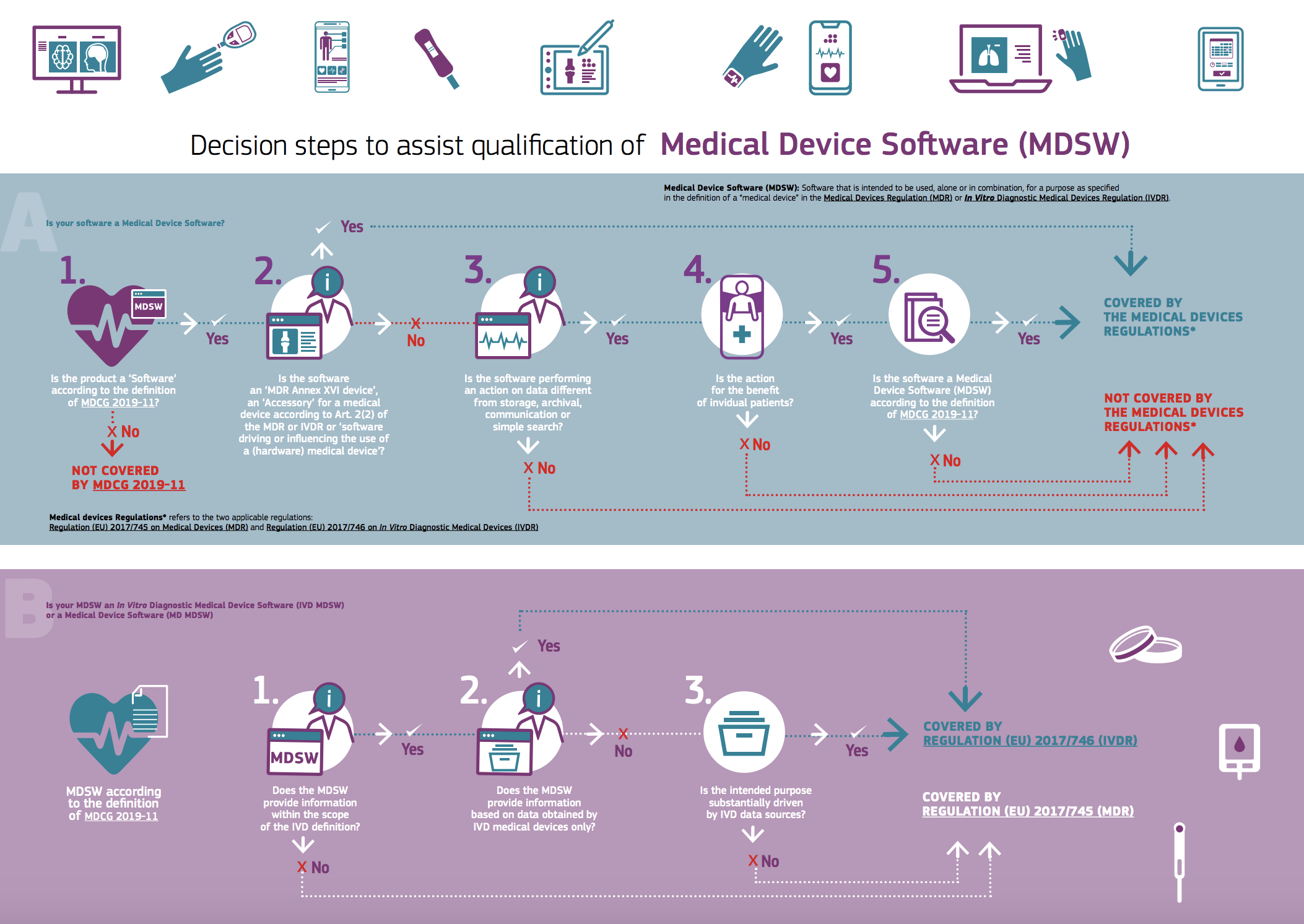
Stabilire quando un software debba essere qualificato come dispositivo medico e quindi ricada nell’ambito di applicazione del Reg. UE 2017/475 e quando invece non lo sia è particolarmente rilevante da un punto di vista giuridico ma anche pratico.
Il confine è però spesso molto labile (si veda il nostro approfondimento "La qualificazione e la classificazione dei software come dispositivi medici").
La Direzione generale della Commissione europea per la salute e la sicurezza alimentare ha prodotto un'infografica con l’intento di illustrare gli step decisionali ed aiutare il fabbricante nella qualificazione del software come dispositivo medico.
Clicca per ingrandire l'infografica